- تاریخ ثبتنام
- 28/6/20
- ارسالیها
- 1,771
- پسندها
- 22,377
- امتیازها
- 46,373
- مدالها
- 23
- سن
- 22
- نویسنده موضوع
- #1
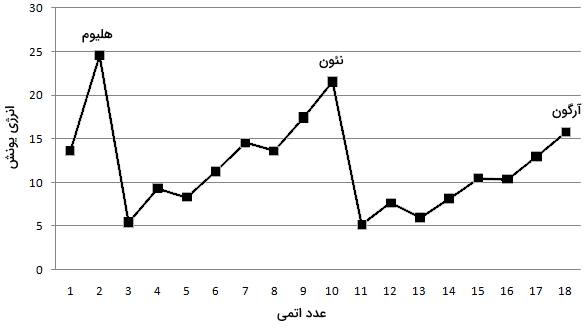
انرژی یونش، به انرژی مورد نیاز برای جداکردن یک الکترون از اتم خنثی در فاز گاز میگویند. از لحاظ مفهومی، انرژی یونش، مفهوم مقابل الکترونگاتیوی به شمار میآید. هر قدر این انرژی کمتر باشد، اتم راحتتر به کاتیون تبدیل میشود. به طور کلی، عناصر سمت راست جدول تناوبی، انرژی یونش بیشتری دارند چراکه لایه ظرفیت آنها تقریبا پر شده است. عناصر سمت چپ جدول تناوبی، انرژی یونش کمی دارند زیرا تمایل آنها برای از دست دادن الکترون و تبدیل شدن به کاتیون، بیشتر است. در نمودار زیر، انرژی یونش از هیدروژن تا آرگون را بر اساس عدد اتمی ملاحظه میکنید.